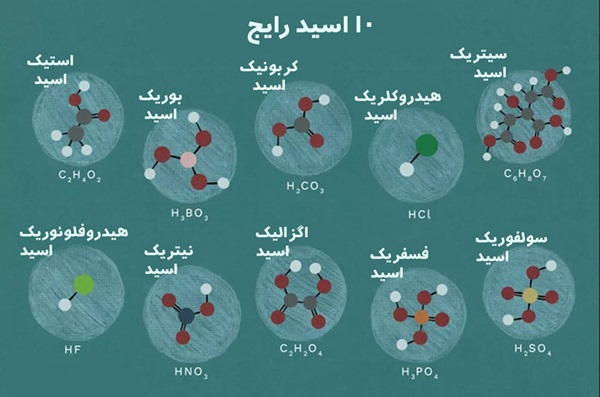
اسید آلی | اسید معدنی
متانول
20/10/1399
7 محلول شوینده خانگی خطرناک
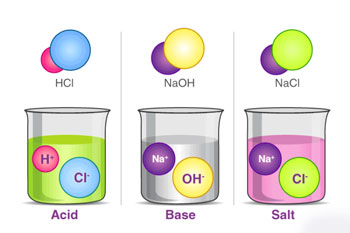
21/10/1399اسیدها ترکیبات شیمیایی هستند که هنگام حل شدن در آب، طعمی تند داشته، عامل خوردگی فلزات هستند و رنگ آبی را به رنگ قرمز تبدیل می کنند. درحالی که بازها حالتی صابونی داشته و رنگ قرمز را به آبی تغییر میدهند. اسید و بازها می توانند در اثر ترکیب شدن با هم محصولی خنثی ایجاد نمایند به گونه ای که محصول نهایی هیچ کدام از ویژگی های اسید یا باز را نداشته باشد. در اینجا قصد داریم در رابطه با تعریف اسید و ویژگی های اسیدهای آلی و اسیدهای معدنی بحث نماییم.
اسید آلی و اسید معدنی چه تفاوتی با هم دارند؟
معمولا اسیدها را به دو دسته اسید آلی و اسید معدنی طبقه بندی می کنند. ترکیبات آلی که خواص اسیدی دارند را اسید آلی می نامند، به عبارت دیگر این اسیدها منشا معدنی ندارند و از نظر ارگانیک بودن باید در ساختار خود یک اتم کربن داشته و از نظر اسیدی مقدار PH آن ها کمتر از 7 باشد.
برخی از اسیدهای آلی نسبت به اسیدهای معدنی واکنش پذیری کمتری دارند و به همین دلیل گزینه مناسبی برای رفع یا پیشگیری از خوردگی فلزات به حساب می آیند. لازم به ذکر است برخی از اسیدهای آلی مانند اسید سیترات و اسید لاکتات به عنوان محلول های بافری مصرف می شوند.
شایع ترین اسیدهای آلی، کربوکسیلیک اسیدها هستند که اسیدیته آنها به گروه کربوکسیل مربوط می شود. می توان گفت اسیدهای آلی به طور گسترده در طبیعت به عنوان سازنده گیاهان و بافت حیوانات مطرح شده اند.
اسیدهایی که از یک یا چند ترکیب غیرآلی حاصل می شوند را اسید معدنی می نامند. در واقع عناصر اصلی این اسیدها، هیدروژن و عناصر غیرفلزی است. اسیدهای معدنی محلول در آب بوده و یون هیدروژن آزاد می کنند و خاصیت بارز این نوع از اسیدها خورنده بودن آنها است. اسیدهای معدنی در طیف اسیدهای بسیار قوی تا اسیدهای ضعیف دسته بندی می شوند که قدرت اسیدیته آنها براساس میزان یون هیدروژن تولید شده در آب بیان می شود. لازم به ذکر است که این اسیدها در محلول های آلی حلالیت بسیار کمی دارند.
تعریف لاووازیه از اسید
می توان گفت در سال 1776 میلادی، آنتوان لاووازیه شیمیدان فرانسوی اولین تعریف علمی از اسید و باز را ارائه داد. با توجه به اطلاعات محدود لاووازیه از اسیدها، وی اسید را براساس محتوای اکسیژن تعریف نمود، به عبارت دیگر از نظر وی اکسیژن عنصر اصلی سازنده اسیدها بود و او از وجود هیدروهالیک اسیدها اطلاعی نداشت.
تعریف لاووازیه از اسید حدود 30 سال مورد قبول همه بود تا اینکه شیمیدان بریتانیایی به نام سر همفری دیوی در کارهای خود عدم وجود اکسیژن در ترکیبات اسیدهای هیدروژن هالید را به اثبات رسانید و با تحقیقات خود فراگیر نبودن تعریف لاووازیه را اثبات کرده و اعلام کرد عنصر اصلی در ساختار تمام اسیدها هیدروژن است.
طبق تعریف دیوی می توان اسید را اینگونه معرفی کرد:
ترکیباتی که در ساختار آنها اتم هیدروژن وجود دارد و می توان این اتم را طی واکنشی با یک اتم فلزی جایگزین نمود، اسید نامیده می شود.
اسید آرنیوس
در سال 1890 سوانت آرنیوس شیمیدان سوئدی که بر روی رسانایی الکتریکی و برقکافت ترکیبات محلول در آب پژوهش میکرد، به مدل جدیدی برای اسید و باز دست یافت. طبق تعریف آرنیوس، اسیدها در محلول آبی یون هیدروژن و بازها یون هیدروکسید تشکیل میدهند.
اسید برونستد-لوری
در سال 1923 تعریف متفاوتی از اسید و باز توسط دو شیمیدان به نام ماتین لوری و یوهانس نیکولاس برونستد ارائه شد. طبق تعریف برونستد-لوری اسید ماده است که پروتون یا همان یون هیدروژن آزاد میکند و باز ترکیبی است که پروتون را دریافت می کند.
در تعریف آرنیوس از ترکیب هیدروژن و هیدروکسید آزاد شده از اسید و باز، آب حاصل می شود. به بیان دیگر حاصل ترکیب اسید و باز آرنیوس، آب و نمک است.
نمک + آب → اسید + باز
درحالی که برونستد و لوری محصولات این واکنش را اسید و باز مزدوج می نامند که در این ترکیب مولکول های آب به عنوان آمفوتر وجود دارد. در واقع در تعریف آنها ترکیبی به عنوان آزاد کننده پروتون و ترکیب دیگر دریافت کننده پروتون است و یک اسید می تواند باز مزدوج اسید دیگری را به شرط دارا بودن قدرت اسیدی بالاتر، پروتون دار نماید.
اسید لوویس
درنهایت در سال 1923 گیلبرت نیوتن لوویس، تعریف دیگری از اسید و باز را ارائه داد که در این تعریف جابه جا شدن جفت الکترون ها تعیین کننده اسید و باز بودن ترکیبات در واکنش های آبی و غیرآبی است. اسید لوویس، پذیرنده یک زوج الکترون است و باز لوویس، دهنده زوج الکترون به شمار می رود.
جدول مقایسه اسیدهای آلی و معدنی
| اسیدهای آلی | اسیدهای معدنی |
|---|---|
| یک ترکیب آلی دارای خواص اسیدی | یک ترکیب معدنی با خواص اسیدی |
| در ساختار خود اتم کربن دارد | اغلب اسیدهای معدنی در ساختار خود فاقد کربن هستند |
| اغلب اسیدهای ضعیفی هستند | اغلب اسیدیته بالایی دارند |
| در بیشتر موارد در آب محلول نیستند | بیشتر این اسیدها محلول در آب هستند |
| قابل حل در محلول های آلی هستند | در محلول های آلی نامحلول هستند |
| دارای منشا بیولوژیک هستند | فاقد منشا بیولوژیک هستند |
| باعث تسریع حذف زنگ زدگی می شود | خاصیت خورندگی بالایی دارند و باعث خوردگی فلزات می شوند |
انواع اسیدهای آلی
| نام اسید | خواص اسید | کاربردها |
|---|---|---|
| اسید لاکتیک | مایعی تقریبا بی رنگ فعالیت ضدمیکروبی دارد و بر روی رشد و تولید سم باکتری ها اثر مهارکنندگی دارد | مایه محصولات لبنی و تخمیری باکتری های این اسید به هضم لاکتوز، ترمیم زخم های گوارشی، تعدیل سیستم ایمنی و غیره کمک می کند |
| اسید استیک | دارای طعم ترش و شبیه طعم سرکه نسبت به اسید لاکتیک خاصیت مهارکنندگی بیشتری دارد | به دلیل انحلال بالا در محلول های قطبی و غیرقطبی طیف وسیعی از کاربردها را در صنعت شامل می شود |
| اسید سیتریک | اسیدی ضعیف است که یک نگهدارنده طبیعی است | جهت ایجاد طعم ترش در غذاها و نوشیدنی ها در صنایع غذایی، دارویی و بهداشتی بسیار پرکاربرد است افزودن آن به جیره غذا منجر به کاهش جمعیت عوامل بیماری زا و بهبود هضم پروتئین، کلسیم، فسفر و منیزیم می شود |
| اسید فرمیک | حلالیت بالا در آب و حلال های قطبی | نگهدارنده و ضدباکتری در خوراک دام جلوگیری از فساد غذای زمستانی دام ها |
انواع اسیدهای معدنی
| نام اسید | خواص اسید | کاربردها |
|---|---|---|
| هیدروکلریک اسید | محلول شفاف و بی رنگ خورنده بسیار قوی | واکنشگر در تولید پلاستیک VVC ساخت ژلاتین افزودنی غذایی چرم سازی |
| سولفوریک اسید | اسیدی بی رنگ و بسیار قوی | تولید کود شیمیایی فسفاته استخراج مس، اورانیوم، وانادیوم سنتز مواد شیمیایی مختلف |
| اسید فسفریک | در حالت خالص به صورت کریستال های جامد و سفید رنگ است در دمای بالا مولکول های آن قادر به واکنش با هم و تشکیل زنجیره های پلیمری کوتاه است | افزودنی در نوشابه های گازدار تولید کودهای شیمیایی فسفاته پاک کننده صابونی و غیر صابونی مکمل خوراک دام و طیور تصفیه آب |
| اسید بوریک | یک اسید ملایم است که به صورت بلورهای بی رنگ یا پودر سفید حلال در آب وجود دارد | اغلب به منظور ضدعفونی کردن و گندزدایی و نیز کنترل سرعت شکاف هسته ای کاربرد دارد |
| نیتریک اسید | اسید معدنی بسیار قوی و بی رنگ است خورندگی بالایی داشته و عامل اکسایش بسیار قوی است | تولید کودهای شیمیایی تولید مواد منفجره در صنایع نظامی و حفاری های غیرنظامی در آماده سازی فلزات برای عملیات ضدخوردگی |
| پرکلریک اسید | اسیدی بسیار قوی است که به صورت مایع بی رنگ و فرار است | پیش ماده ای برای پرکلرات آمونیوم است که در سوخت موشک به کار می رود رنگ زدایی نمایشگرهای کریستالی مایع ترکیبی مفید در رنگ زدایی کروم |
| هیدروفلوئوریک اسید | گازی بی رنگ با بویی تند | ماده خورنده در بسیاری از پاک کننده ها عامل اکسید کننده و کاهنده حلال در بسیاری از مصارف صنعتی قابل استفاده در محصولات تصفیه آب |
| هیدروبرمیک اسید | این اسید می تواند بین بی رنگ تا زرد کمرنگ متغیر باشد این اسید در دمای اتاق پایدار بوده ولی درمعرض نور و هوا تغییر رنگ میدهد | واکنشگر مناسب در تولید ترکیبات اورگانوبرم قابل استفاده در فرایندهای پلیمریزاسیون، هیدروژن زدایی و استری کردن |
اسیدهای قوی و اسیدهای ضعیف
قدرت یک اسید براساس قابلیت تفکیک شدن اسید به یون های خود در محلول بیان می شود. به عبارت دیگر، قدرت اسید بیان کننده توانایی اسید در آزاد کردن یون های هیدروژن خود در یک محلول است.
اسید قوی اسیدی است که در آب به طور کامل به یون های خود تجزیه می شود. چنین اسیدی در هر مولکول خود حداقل یک کاتیون هیدروژن دارد.
درحالی که برای اسیدهای ضعیف قابلیت تفکیک به یون های خود کمتر از 1% بیان شده است. این درصد پایین بدین معنا است که تعداد بسیار کمی از مولکول های آن قادر به جدا کردن یون هیدروژن خود هستند.
برای بیان قدرت اسید در یک محلول از مقدار ثابت تفکیک اسید (Ka) استفاده می شود. اسیدهای قوی مقدار Ka بالا و یا PKa پایینی دارند و برای اسیدهای ضعیف این مقادیر برعکس هستند.

مقایسه اسید قوی با اسید غلیظ
لازم است بدانید اصطلاح اسیدهای قوی و ضعیف با اسیدهای غلیظ و رقیق متفاوت است. ولی متاسفانه عده ای به اشتباه این دو اصطلاح را یکی دانسته و به جای هم به کار می گیرند.
در بالا با تعریف اسید قوی و ضعیف آشنا شدید. حال اسید غلیظ چیست؟
غلظت یک اسید را براساس مقدار آب یا حلال موجود در محلول اسیدی تعیین می کنند و هرچه نسبت اسید به حلال یا آب بیشتر باشد، اسید غلیظ تر خواهد بود. شما می توانید یک اسید قوی غلیظ و یا رقیق داشته باشید.
پس همواره به یاد داشته باشید غلظت اسید نشان دهنده میزان قدرت اسیدی آن نیست.

خورندگی اسیدها
قوی بودن یک اسید به معنای خورندگی بالای آن اسید نیست.
خورندگی اسید به میزان تخریب اسید از سطحی که با آن در تماس است، اشاره دارد. با توجه به اهمیت اسیدها در آزمایشگاه ها و استفاده زیاد از آنها توسط افراد، اغلب خورندگی اسید را براساس میزان تاثیری که بر پوست و بافت زنده دارد، بیان می کنند.
برخی از اسیدهای قوی قدرت خورندگی بسیار بالایی دارند. به عنوان مثال اسید کلریدریک می تواند باعث خوردگی فولاد ضدزنگ شود و یا اسید سولفوریک که به دلیل خورندگی بالا به عنوان لوله بازکن استفاده می شود. همچنین اسید هیدروفلوئوریک که یک اسید ضعیف است باعث خورده شدن استخوان می شود.
غلظت در اسیدهای خورنده اهمیت زیادی دارد. زیرا کاهش غلظت یک اسید خورنده باعث کاهش در اثر خورندگی آن نیز می شود؛ و درصورت کم بودن غلظت می تواند باعث تحریک پوست شده و یا خارش و قرمزی پوست را سبب شود.
قیمت و خرید انواع اسیدهای صنعتی
بازرگانی کیمیا شیمی پایدار ازجمله تأمین کنندگان مواد شیمیایی صنعتی و خوراکی است که همواره اصل بودن محصولات عرضه شده را در دستور کار خود قرار داده است. جهت اطلاع از قیمت و خرید اسیدهای صنعتی به صورت عمده با کارشناسان فروش بازرگانی تماس حاصل نمایید.
021-77738301
021-77738302
021-77738303